礼来亚洲基金:看好具有全球市场潜力的首创新药,资本市场认可licenseout交易
本文转载至微信公众号 “IPO早知道”,作者“Stone Jin”,贝壳投研经授发布。
礼来亚洲基金重点关注有潜力研发下一个全球首创新药(First in class)的公司。
自港交所与科创板改变上市章程以来,国内创新药引来黄金发展机遇,便利的融资环境助推产业高速发展。
当然,另一方面,这一市场利好也造成热门靶点扎堆的同质化竞争局面——譬如,仅PD-1在国内的临床数量就有上百个,大量重复的临床试验是对社会资源的浪费。
在日前举行的一场媒体沟通会上,礼来亚洲基金副总裁冯婷博士指出,综合国内的药价、支付体系、商业环境等因素,中国市场未来五到十年的竞争可能会加剧。
冯婷强调,破局之道的关键在于全球市场,“如果中国创新药能够走出去,走到全球,未来的市场潜力就是五倍甚至是十倍的增加。”
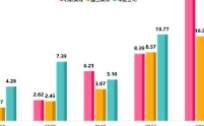
从行业数据来看,全球处方药市场约9000亿美元,中国市场的占比不足10%,若去除仿制药和中成药,国内的创新药市场约400亿美元。冯婷介绍,从大型跨国药企的销售数据来看,中国市场在全球营收的占比约为5%-10%,阿斯利康高一些约20%。这一数据说明,中国创新药出海将会获得更大商业回报。
“现在很多公司都在讲通过license out出海,但是否能真的做到,取决有两点,第一在于产品本身是否具有创新性,能否做到全球前三。第二点,药物的相关数据是否可靠,以及专利保护是否健全。”
此外,冯婷亦强调,国内制药行业正从仿制药向Me-too、Fast follow转型,进而出现攻克First in class类药物的企业,“创新药的标准越来越高,礼来亚洲基金重点关注有潜力研发下一个全球首创新药(First in class)的公司。”
近年来,FDA获批的新药中,超过60%的新药经过一次以上的授权交易,获批的肿瘤药几乎全部经过授权交易,目前中国创新药企业的在研产品也朝着一方向发展。
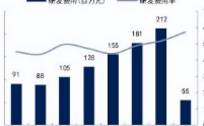
Cotelis数据库则显示,2020年中国创新药向海外授权的交易数量约130起,较2019年增长近60%,2020年有多个超过10亿美元的交易产生,例如天境生物的CD47抗体授权给艾伯维,信达生物的PD-1授权给礼来,加科思的SHP2抑制剂授权给艾伯维。
这里不妨以加科思向艾伯维license out其自主研发的SHP2抑制剂为例,双方在2020年5月底达成合作协议,交易金额超过8.55亿美元(约55亿元),研发加科思保留中国地区的全部权益,海外市场的权益属于艾伯维,加科思将从全球市场的销售额中获得百分之十几的销售分成,作为净利润,研发费用将由艾伯维报销。高盛在一份研报中预测称,加科思的SHP2抑制剂或在2025年产生销售收入,2030年或为公司带来55亿元的收入。
“资本市场非常喜欢license out交易,因为投资机构能通过交易金额以及海外市场的销售额和销售分成计算潜在的商业回报,这部分收入对公司未来的财务报表和整体的现金流都是非常有帮助的。”冯婷认为。
冯婷进一步指出,“礼来亚洲基金在挑选创新药投资标的是,要么寻找已经在国外被验证的产品或技术,在国内快速跟进并做出差异化,要么寻找全球最新的靶点,加科思属于第二类,全球最新。”她强调,产业界的创新并非天马行空,而是寻找“已被验证的肿瘤信号通路上的靶点”。SHP2处于PD-1和RAS两条肿瘤信号通路,投资加科思时,PD-1的有效性已被验证。
“Biotech和大的跨国药企合作,由跨国药企主导大型的三期临床甚至是后期的商业化,这是美国制药界都已经走了无数遍,也是市场非常认可的一条路,”冯婷表示。
值得注意的是,7月2日,CDE(国家药品管理局药品审评中心)发布《以临床价值为导向的抗肿瘤药物临床研发指导原则》的征求意见稿,其核心思想包括新药研发应以为患者提供更优的治疗选择为最高目标,当选择非最优的治疗作为对照时,即使临床试验达到预设研究目标,也无法说明试验药物可满足临床中患者的实际需要,或无法证明该药物对患者的价值。
鉴于CDE负责国内新药临床试验审批,因此这一征求意见稿某种程度上可视作me too药同质化竞争降温的信号。这一政策让仿制药企业面临更严峻的政策环境,从长远来看,对行业是真正的利好:限制不必要的同质化竞争,优化临床资源分配,有助于推动中国创新药研发逐步进入first in class时代。
飞鲸投研从多维度分析,整理了一份《成长50》的名单,可以关注同名公众号:"飞鲸投研":feijingtouyan,进行领取(点击复制)