百亿美金入场豪赌,CD47靶点的诱惑与“陷阱”
编辑按:本文转载至微信公众号 “氨基财经”,贝壳投研经授发布 。
PD-1,十年难遇的大靶点,成就了默沙东,恒瑞,也吸引了无数想要逆袭的后来者。
但大部分药企的PD-1故事还没开讲,便破灭了。面对拥挤的PD-1赛道,很多药企不愿再“卷”,纷纷另辟蹊径,试图找到另一条路无人走过的路。
尚未有药品上市的CD47市场,成了不少药企梦想中的蓝海。
一时间,入局者众多,重磅交易频现。去年3月份,吉利德科学掷下重金,以49亿美元的价格,收购了专门研究针对CD47靶点免疫疗法的ForthSeven公司。
6个月后,CD47市场再现大额交易。艾伯维以19.4亿美元的价格,引进了天境生物的CD47单抗。
除吉利德科学、艾伯维外,还有许多药企“默默”参与其中。仅国内,就有包括信达生物、康方生物等公司在内的十余名玩家。
免疫治疗时代,大家都希望找到下一个吸金靶点。那么,近百亿美金押注,CD47靶点能满足大家的期待么?
/ 01 /困境:难以避开的不良反应
CD47靶点要想成为下一个PD-1,还有很长的路要走。
核心原因在于由于CD47蛋白广泛存在于正常细胞,靶向药物难分敌我,副作用明显。要理解这一点,还要从人体免疫系统说起。
人体先天免疫系统堪称电脑杀毒软件。当病原体等有害“军团”入侵人体,先天免疫系统可以立即识别病原体,并做出“消杀”反应。
其中,巨噬细胞便是能够杀死肿瘤细胞的“安全卫士”之一。
巨噬细胞的活性受“吃”和“不吃”的信号控制。肿瘤细胞表面可能会表达“吃”信号(例如钙网蛋白),使巨噬细胞能够识别并消灭它们。

为了抵消这种可见性,狡猾的肿瘤细胞,往往会表达高水平的CD47蛋白,它通过与巨噬细胞表面的信号调节蛋白SIRPa结合,可以传递“不要吃我”的信号。
CD47蛋白的过度表达,在所有类型的肿瘤中都很常见,包括非霍奇金淋巴瘤、结直肠癌或胃癌、肺癌等。研究表明,这与更具侵袭性的疾病和较差的存活率相关。
为了应对这一情况,各大药企们开始着眼于研究针对CD47靶点的药物,希望通过阻断吞噬细胞与癌细胞之间的信号交流,让吞噬细胞正常工作,杀灭癌细胞。
不过,知易行难。针对CD47靶点的药物研究,折戟者不在少数。2017年5月24日,ArchOncology开启了CD47药物一期临床试验。没想到的是,仅在首例患者入组后,就发生了意外。
该患者接受药物治疗第2天,就因为红细胞凝集而死亡,ArchOncology也被迫终止了该款CD47药物的研发。
无独有偶,2018年10月,新基公司低调终止了CD47单抗临床试验CC-90002的受试者招募。原因在于,CC-90002临床试验数据疗效及安全性均不佳。
两家公司接连败北,无疑让CD47药物的研究进入寒冬。严重的不良反应,成了横在CD47药物研发道路上的一块巨石。
为何CD47药物频频出现严重不良反应?
这是因为,CD47蛋白广泛表达于我们的正常细胞中,而不仅限于癌细胞。
虽然仅仅阻断CD47-SIRPα的相互作用,不足以引发吞噬作用,还需要钙网蛋白等“吃我”信号的助攻。但在肿瘤细胞、衰老的红细胞和血小板,阻断CD47-SIRPα的相互作用会直接引发吞噬作用。
换句话说,红细胞减少和血小板减少是CD47靶点药物成药性的最大挑战。如何在杀伤肿瘤细胞的同时,避免误伤到红细胞,成了一个棘手问题。
/ 02 /破局:多种方案攻克难题
面对CD47靶点的开发难点,各大药企可以说是绞尽脑汁。近年来,各类方案层出不穷,并且曙光渐现。
不过,不同的解决方式,效果也不尽相同。那么,目前的改进方式有哪些,效果又如何呢?
1)通过对抗体亚型的选择,减少红细胞毒副作用
抗体的本质是IgG(免疫球蛋白)。因为二硫键数目和位置各不相同,免疫球蛋白共有4个亚型:IgG1、IgG2、IgG3、IgG4。
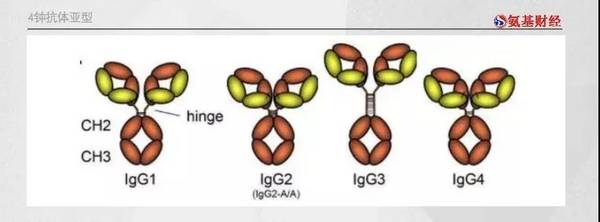
亚型不同,免疫球蛋白的功能并不一致,在血浆中的含量也是不同。血浆中IgG1含量最高,达60%—70%,IgG2含量为20—30%,IgG3含量只有5—8%,IgG4含量则只有1-4%。

可以看到,IgG4亚型在血浆中含量较低。以该亚型为主体的CD47单抗,基本不会接触红细胞,那么毒副作用自然有限。
诸如FortySeven、Celgene等药企,就采用IgG4亚型抗体,以降低对红细胞的杀伤作用。
事实证明,通过采用IgG4亚型抗体,副作用的确可以降低。根据FortySeven2019年年报,该公司CD47单抗magrolimab给药剂量,已经爬坡到45mg/KG。剂量越高说明潜在疗效越好,这表明公司的研发较为顺畅。
这种方式,简单来说就是“惹不起,躲得起”,通过牺牲药物疗效的方式,换取安全性。那么,是否可以让药物直面红细胞,但不会与其结合呢?
2)降低CD47药物和红细胞的结合能力
答案,是肯定的。
CD47与巨噬细胞表达的SIRPα结合,才能传递抑制信号。理论上,切断CD47-SIRPα信号通路有两种,一是针对CD47,另一个是针对SIRPα。
在SIRPα领域,海外生物科技公司Trillium发现了一种神奇的亚型——天然变体V2的Domain1,这一亚型可以高亲和力结合肿瘤细胞表面的CD47,但不结合红细胞表面的CD47。
基于这一发现,Trillium开发了两款SIRPα融合蛋白TTI-621和TTI-622。
两款药物的不同在于Fc亚型,TTI-621融合了IgG1亚型抗体片段,理论上战斗力更强;TTI-622融合了IgG4亚型片段,战斗力偏弱。
不过目前来看,TTI-621没能满足Trillium的期待。
因为血小板毒性因素问题,TT-621给药只能爬坡到2mg/kg剂量。但幸运的是,TTI-622已经爬坡到18mg/kg,在不同治疗窗口下,TTI-622疗效与安全兼顾,将会是Trillium接下来开发的重心。
既然SIRPα可以结合肿瘤细胞表面的CD47,而不结合红细胞表面的CD47,说明红细胞表面CD47与肿瘤细胞CD47存在着差异。
那么,是否存在一种CD47抗体只结合肿瘤细胞,而不结合红细胞呢?答案依然是肯定的。
天境生物便通过反向筛选的方式,找到了一款天赋异禀的CD47单抗TJC4:
该抗体在保留促进吞噬细胞活性和抗肿瘤药效的同时,与正常红细胞上的结合十分微弱,以至于抗体本身不会引起红细胞凝集现象,这一特性可以最大限度减少抗体注射后带来贫血等副作用。
根据天境生物年报,TJC4在临床中剂量已爬坡到30mg/kg。在GLP食蟹猴毒理实验中,TJC4在重复给药高达100mg/kg的高剂量下展现出良好的耐受性。理论上,TJC4的临床剂量未来还有上升的可能。
3)直接放弃CD47抗体的“杀伤力”
在如何避免红细胞毒性的探索中,还有以ALX Oncology为代表的生物科技公司。这类公司的想法更加直接,放弃CD47抗体的“杀伤力”,只要求它发挥“开关”作用。
抗体之所以能消灭目标蛋白,与其身体上的“Fc域”有关。“Fc域”可以呼唤友军免疫细胞登场,对病原体进行“消杀”。
基于此,ALX Oncology选择让“Fc域”灭活。该公司设计的融合蛋白ALX148,便由CD47结合域和灭活的Fc结构域组成。
虽然ALX148可以同时结合肿瘤细胞和红细胞表面的蛋白,但不会伤害红细胞,也没有治疗肿瘤的效果。据ALX Oncology 2018年在ASCO会议披露的数据,ALX148单药对于实体瘤的客观缓解率为0。也就是,该药物对患者没有疗效。
不过,从剂量来看,ALX148的开发也相对顺畅。根据ALX Oncology年报,ALX148剂量已爬坡至15mg/kg。
看到这里你或许会有疑惑,没有疗效,那么ALX Oncology的目的是什么呢?很简单,公司希望探索联合治疗的方式。
通过ALX148关闭肿瘤细胞“别吃我”的信号通路,让肿瘤细胞暴露的同时,结合其他抗肿瘤药物治疗,以起到更好的效果。这也是当前的研发趋势之一。
/ 03 /抉择:双抗、联合用药谁才是出路?
大多数在研的CD47药物,由于需要规避红细胞毒性,导致单药效果都不尽如人意,因此,联合用药正在成为一大趋势。
在单药疗效方面,先驱FortySeven 30mg/kg组的患者客观缓解率仅10%,TTI-622的客观缓解率虽然高达33%,但囿于血小板毒性因素,困难重重。而TTI-621目前的客观缓解率为18—29%,也不“够用”。
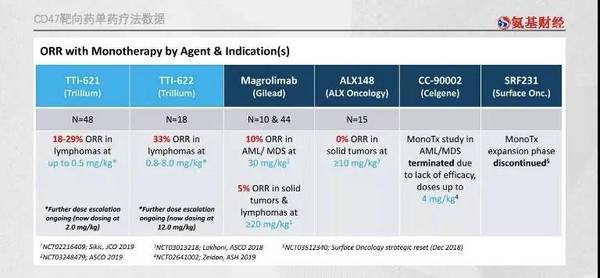
而在联合疗法中,已经有药企的产品展现出不错的疗效。
仍以FortySeven的magrolimab为例,虽然其针对急性髓系白血病和骨髓增生异常综合征的客观缓解率仅为10%,但其与阿扎胞苷联合治疗的客观缓解率分别高达92%和64%。
疗效不错的同时,安全性方面也是足够突出,目前并未有患者因不良反应而停止治疗。
这不让人意外。正如ALX Oncology的思路一样,在“不要吃我”信号通道得到关闭的情况下,更多的肿瘤细胞会“暴露”,这个时候结合其他抗肿瘤药物,无疑能起到更好的效果。
基于这一思路,国内外药企也纷纷将目光瞄向双抗领域。因为双抗结构的特殊性,对于避免血液毒性或许会有意外惊喜。
以信达生物的CD47/PD-L1双抗IBI-322为例。IBI-322既能刺激巨噬细胞产生吞噬作用,又能阻断PD-1信号通路,通过两种机制一起发挥作用,强化了对肿瘤细胞的杀伤力。
由于PD-L1的亲和力强于CD47,这意味着与抗CD47单抗相比,IBI322可以更有效地选择性结合肿瘤细胞,从而降低与红细胞上表达的CD47结合的可能性,降低抗CD47抗体相关的毒性。
根据IBI-322的临床前数据,CD47双抗比单抗具有更好的杀肿瘤功效,并且很好的降低了药物副作用。
也正因此,药企一哥恒瑞虽然在2019年4月终止了CD47单抗的研究,但2020年9月10日,恒瑞公开了PD-L1/CD47双抗专利。想必,恒瑞对于CD47的布局应该也并未停止。
当然,双抗的设计思路多种多样,目前已有十余家药企布局CD47双抗,其中宜明昂科、杭州翰思生物、尚健生物均已获批进入一期临床试验。这也让人对CD47双抗的未来充满期待。
至于CD47药物未来的方向往哪里走,双抗、联合用药谁才是王道,我们还需要等待双抗领域更多的数据。
但可以明确的是,CD47药物未来的前景,一定值得期待。
/ 03 /未来:国内不可避免的内卷
对于一个靶点来说,前景是否足够诱人,取决于患者群体规模。
PD-1抑制剂之所以大放异彩就得益于此。基本所有癌种,都存在PD-L1/PD-L2高表达现象。
从这个角度来说,CD47有成为下一个PD-1的潜质。正如上文提及,几乎所有癌种,也均有CD47高表达现象。只不过,受限于毒副作用,CD47还在探索之中。
出于对下一个PD-1的渴望,尽管CD47靶点的研发困难重重,但丝毫没有影响国内药企的积极性。目前,已有10余家药企布局CD47靶点研发,其中已进入I期临床试验的,包括信达生物、天境生物、康方生物、杭州、翰思生物、宜明昂科、天广实、恒瑞医药。
这场结果未定的比赛,没人愿意落后。
最典型如信达生物,同时布局了3个研发方向:包括CD47单抗、PD-L1/CD47双抗、以及SIRP-α单抗(引进)。不难看出,信达生物希望多条腿走路,来确保该靶点万无一失。
目前,信达生物的CD47单抗IBI188进展国内最快,联合疗法Ib/III期研究的国际多中心试验,已经有患者开始入组。
一些未上市的药企,也不甘落后。2020年10月,宜明昂科获得礼来亚洲基金领投的2500万美元B轮投资,主要用于推进旗下CD47单抗药物IMM01、IMM0306的临床试验。
与信达生物一样,宜明昂科也选择了多条腿走路。今年7月初,CDE官网显示,宜明昂科CD47×Her2双抗临床获批。
入局者多,也意味着竞争激烈。对于一款药物来说,先发优势极为重要。在率先上市的情况下,往往可以更轻松地占领市场。后来者如果没有疗效优势,销售能力也跟不上,那大概率只能陪跑。
谁能在CD47市场胜出,让我们静待时间给出答案。
飞鲸投研从多维度分析,整理了一份《成长50》的名单,可以关注同名公众号:"飞鲸投研":feijingtouyan,进行领取(点击复制)
/阅读下一篇/